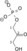Triozafosfat izomeraza
| Triozafosfat izomeraza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Bočni pogled na monomer trioza P izomeraze, aktivno mesto je u centru gore | |||||||||
| Identifikatori | |||||||||
| EC broj | 5.3.1.1 | ||||||||
| CAS broj | 9023-78-3 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA pristup | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG pristup | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| Strukture PBP | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Ontologija gena | AmiGO / EGO | ||||||||
| |||||||||
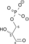
Triozafosfat izomeraza (TPI ili TIM) je enzim (EC 5.3.1.1) koji katalizuje reverzibilnu interkonverziju trioza fosfat izomera dihidroksiaceton fosfat i D-gliceraldehid 3-fosfat.
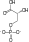
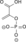
| Dihidroksiaceton fosfat | triozafosfat izomeraza | D-gliceraldehid 3-fosfat | |
 |  | ||
 | |||
| triozafosfat izomeraza | |||
Јedinjenje C00111 u KEGG Metabolički put bazi podataka.Enzim 5.3.1.1 u KEGG Metabolički put bazi podataka.Јedinjenje C00118 u KEGG Metabolički put bazi podataka.
TPI učestvuje u glikolizi i esencijalna je za efikasnu produkciju energe. Ovaj enzim je prisutan u skoro svim organizmima, uključujući životinje poput sisara i insekata, kao i gljive, biljke, i bakterije. Bakterije koje ne izvode glikolizu, poput Mycoplasmataceae, nemaju TPI.
Kod ljudi je deficijencija triozafosfat izomeraze progresivan i jak neurološki poremećaj. On je karakterisan hroničnom hemolitičkom anemijom. Postoje mnoge mutacije koji mogu da uzrokuju ovu bolest. Većina njih uključuje mutaciju glutaminske kiseline u poziciji 104 u aspartinsku kiselinu.[1]
Triozafosfat izomeraza je veoma efikasan enzim, koji ubrzava reakciju više milijardu puta u odnosu na nekatalisanu reakciju. Ta reakcija je efikasna u toj meri da se naziva kinetički perfektnom. Ona je jedino ograničena brzinom difuzije supstrata u i iz aktivnog mesta enzima.[2][3]
Vidi još
- TIM barel
- Deficijencija trioza fosfat izomeraze
- TPI1
Reference
- ^ Orosz, F.; Oláh, J. (2008). „Triosephosphate isomerase deficiency: facts and doubts”. IUBMB Life. 58 (12): 703—715. PMID 17424909. doi:10.1080/15216540601115960.
- ^ Albery, W. J.; Knowles, J. R. (1976). „Free-Energy Profile for the Reaction Catalyzed by Triosephosphate Isomerase”. Biochemistry. 15 (25): 5627—5631. PMID 999838. doi:10.1021/bi00670a031.
- ^ Rose, I.A.; Fung, W.J. (1990). „Proton diffusion in the active site of triosephosphate isomerase”. Biochemistry. 29 (18): 4312—4317. PMID 2161683. doi:10.1021/bi00470a008.
Literatura
- Nicholas C. Price; Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third изд.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 изд.). Wiley-Interscience. ISBN 0471205036.
- Branden C; Tooze J. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 изд.). Wiley Classics Library. ISBN 0471303097.
- William P. Jencks (1987). Catalysis in Chemistry and Enzymology. Dover Publications. ISBN 0486654605.
Spoljašnje veze
- Triosephosphate isomerase in interactive 3D at Proteopedia
- Triosephosphate isomerase (TIM) family in PROSITE
- п
- р
- у
| |
| to oksaloacetat: |
|
|---|---|
| iz laktata (Korijev ciklus): | |
| iz alanina (Alaninski ciklus): | |
| iz glicerola: |
- Fruktoza 6-P,2-kinaza:fruktoza 2,6-bisfosfataza
- PFKFB1, PFKFB2, PFKFB3, PFKFB4
- Bisfosfogliceratna mutaza