2-Merkaptoetanol
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C2H6OS | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | HOCH2CH2SH | ||||||||||||||||||||||||||||||||||||||
| Masa molowa | 78,13 g/mol | ||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||
| Numer CAS | 60-24-2 | ||||||||||||||||||||||||||||||||||||||
| PubChem | 1567 | ||||||||||||||||||||||||||||||||||||||
| DrugBank | DB03345 | ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
2-Merkaptoetanol, BME – organiczny związek chemiczny z grupy tioli, pochodna glikolu etylenowego posiadająca przy węglu C2 (β) grupę tiolową zamiast grupy hydroksylowej. 2-Merkaptoetanol jest stosowany jako odczynnik analityczny i jako substrat do syntez. W wysokich stężeniach redukuje mostki dwusiarczkowe, co prowadzi do degradacji trzecio- i czwartorzędowej struktury białka.
Otrzymywanie
2-Merkaptoetanol można otrzymać m.in. działając siarkowodorem (H
2S) na tlenek etylenu[7]:
Reakcje
2-Merkaptoetanol reaguje z ketonami i aldehydami tworząc odpowiednie 1,3-oksatiolany[8]:
Zastosowanie
Redukcja mostków dwusiarczkowych
2-Merkaptoetanol jest stosowany w biochemii do denaturacji białek, których struktura stabilizowana jest przez mostki dwusiarczkowe, na drodze ich redukcji[9]:
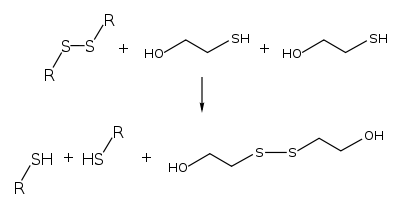
- gdzie R oznacza cysteinę
Reakcja ta pozwala na stwierdzenie, czy mostki dwusiarczkowe biorą udział w stabilizacji struktury czwartorzędowej białka. Jest on jednak względnie silnie toksyczny i może reagować z wolnymi resztami cysteinowymi, dlatego też w analizie częściej stosowany jest ditiotreitol (DTT), który ma również wyższy potencjał redukcyjny w porównaniu do 2-merkaptoetanolu[potrzebny przypis].
Przypisy
- ↑ a b c d e Lide 2009 ↓, s. 3-324.
- ↑ Lide 2009 ↓, s. 8-42.
- ↑ a b Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4 .
- ↑ a b c 2-Merkaptoetanol (nr M6250) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2021-07-01]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ 2-Mercaptoethanol (nr M6250) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2012-06-04]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Lide 2009 ↓, s. 16-14.
- ↑ F.N.F.N. Woodward F.N.F.N., Monothioethylene glycol and thiodiglycol, „Journal of the Chemical Society”, 1948, s. 1892–1894, DOI: 10.1039/JR9480001892 (ang.).
- ↑ Gustavus EdwinG.E. Wilson Gustavus EdwinG.E., M.G.M.G. Huang M.G.M.G., W.W.W.W. Schloman W.W.W.W., Facile synthesis of 1,3-oxathiolanes from ketones and i-mercaptoethanol, „Journal of Organic Chemistry”, 33 (5), 1968, s. 2133–2134, DOI: 10.1021/jo01269a103 (ang.).
- ↑ LubertL. Stryer LubertL., Biochemia, Warszawa: Państwowe Wydawnictwo Naukowe, 1986, s. 46, ISBN 83-01-00140-2 .
Bibliografia
- David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).



















