Gp120


Gp120 is een glycoproteïne aan het oppervlak van de Hiv-virusenvelop. Het werd ontdekt door de professoren Tun-Hou Lee en Myron "Max" Essex van de Harvard School of Public Health in 1984.[1] De 120 in de naam komt van zijn molecuulgewicht van 120 kDa. Gp120 is essentieel voor het naar binnengaan van het virus in de cellen, omdat het een cruciale rol speelt bij de hechting aan specifieke membraanreceptoren. Deze receptoren zijn DC-SIGN (Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin),[2] heparansulfaat[3] en een specifieke interactie met de CD4-receptor,[4] vooral met T-helpercellen. Binding aan CD4 induceert het begin van een cascade van conformatieveranderingen in gp120 en gp41 die leiden tot de fusie van het virusmembraan met het celmembraan van de gastheer. De binding aan CD4 is voornamelijk elektrostatisch, hoewel er vanderwaalskrachten-interacties en waterstofbruggen zijn.[5]
Gp120 wordt gecodeerd door het Hiv-env envelopgen, dat ongeveer 2,5 kb lang is en codeert voor ongeveer 850 aminozuren.[6] Het primaire envelopgenproduct is het eiwit gp160, dat in het endoplasmatisch reticulum door het in het golgicomplex voorkomende protease furine[7] wordt gesplitst in gp120 (~480 aminozuren) en gp41 (~345 aminozuren).[8] De kristalstructuur van de kern van gp120 heeft een buitendomein, een binnendomein met twee uiteinden en een bèta-sheetoverbrugging. Gp120 is verankerd aan de virusenvelop via niet-covalente bindingen met het transmembrane glycoproteïne gp41. Drie gp120's en gp41's worden gecombineerd in een trimeer van hetero-dimeren voor het vormen van envelopspikeiwitten,[9] die voor de hechting aan en het binnendringen van de gastheercel zorgen.

Variabiliteit
Omdat gp120 een cruciale rol speelt in het vermogen van Hiv-1 om T-helpercellen (CD4+-cellen) binnen te dringen, is de evolutie ervan van bijzonder belang. Veel neutraliserende antilichamen binden zich aan plaatsen die zich in variabele regio's van gp120 bevinden, dus mutaties in deze regio's zullen sterk worden geselecteerd.[10] Er is aangetoond dat de diversiteit van env met 1-2% per jaar toeneemt in Hiv-1 groep M en de variabele eenheden vallen op door snelle veranderingen in de lengte van de aminozuursequentie. Een toename van de variabiliteit van gp120 resulteert in aanzienlijk verhoogde niveaus van virale replicatie, wat wijst op een toename van de virale fitheid bij individuen die zijn geïnfecteerd met diverse Hiv-1-varianten.[11] Verdere onderzoeken hebben aangetoond dat variabiliteit in potentieel N-gekoppelde glycosyleringsplaatsen (PNGS's) ook resulteert in een verhoogde virale fitheid. PNGS's maken de binding van koolhydraten met lange ketens aan de gebieden met hoge variabiliteit van gp120 mogelijk, dus de auteurs veronderstellen dat het aantal PNGS's in env de fitheid van het virus zou kunnen beïnvloeden door meer of minder gevoeligheid te bieden voor neutraliserende antilichamen. De aanwezigheid van beschermende, lange koolhydraatketens die zich uitstrekken vanaf gp120 zou mogelijke antilichaambindingsplaatsen kunnen verdoezelen.[12]
De grenzen van het potentieel om PNGS's toe te voegen en te elimineren worden bij de groeiende viruspopulaties na elke nieuwe infectie naïef verkend.[13] Terwijl de gastheer, die het virus doorgeeft, een neutraliserende antilichaamreactie tegen gp120 heeft ontwikkeld, mist de nieuw geïnfecteerde gastheer de immuunherkenning van het virus. Sequentiegegevens laten zien dat initiële virale varianten in een immunologisch onvolgroeide gastheer weinig glycosyleringsplaatsen en kortere blootgestelde variabele lussen hebben. Dit kan het virale vermogen om gastheercelreceptoren te binden vergemakkelijken.[14] Terwijl het immuunsysteem van de gastheer antilichamen tegen gp120 ontwikkelt, lijkt de immuundruk te selecteren voor verhoogde glycosylering, vooral op de blootgestelde variabele lussen van gp120.[15] Dientengevolge kunnen inserties in env die meer PNGS's aan gp120 geven beter worden verdragen door het virus, omdat een hogere glycaandichtheid het virale vermogen om antilichamen te ontwijken vergroot en daardoor een hogere virale fitheid bevordert.[16] In overweging nemend hoeveel de dichtheid van PNGS theoretisch zou kunnen veranderen, kan er een bovengrens zijn aan het PNGS-aantal vanwege de remming van de gp120-vouwing, maar als het PNGS-aantal aanzienlijk afneemt wordt het virus te gemakkelijk gedetecteerd door neutraliserende antilichamen.[13] Daarom ontstaat er waarschijnlijk een stabiliserend selectie-evenwicht tussen lage en hoge glycaandichtheden. Een lager aantal grote glycanen verbetert de efficiëntie van de virale replicatie en een hoger aantal op de blootgestelde lussen helpt het immuunsysteem van de gastheer te ontwijken door middel van vermomming.
De relatie tussen gp120 en neutraliserende antilichamen is een voorbeeld van de evolutionaire dynamiek van Red Queen. Voortdurende evolutionaire aanpassing is vereist voor het virale envelopeiwit om fit te blijven ten opzichte van de voortdurende evolutionaire aanpassingen van de immuunneutraliserende antilichamen van de gastheer, en vice versa, waardoor een co-evoluerend systeem wordt gevormd.[16]
Ontwikkeling van een vaccin
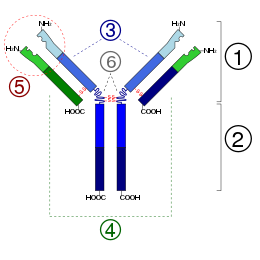
1 antigeen-bindingsgebied (Fab)
2 kristalliseerbaar gebied (Fc)
3 twee zware ketens
4 twee lichte ketens
5 plaats waar het antigeen zich bindt
6 scharniergebied
Omdat binding aan de CD4-receptor de meest voor de hand liggende stap is bij Hiv-infectie, was gp120 een van de eerste gebieden van onderzoek naar Hiv-vaccins. De ontwikkeling van Hiv-vaccins, die zich richten op gp120, wordt echter belemmerd door de chemische en structurele eigenschappen van gp120, die het moeilijk maken voor antilichamen om eraan te binden. Gp120 kan ook gemakkelijk van het oppervlak van het virus worden verwijderd en door T-cellen worden opgevangen vanwege de losse binding ervan met gp41. Een geconserveerd gebied in het gp120-glycoproteïne dat betrokken is bij de metastabiele hechting van gp120 aan CD4 is geïdentificeerd en het breed neutraliserend antilichaam IgG1 (b12) richt zich op het geconserveerde gebied.[17] [18]
NIH-onderzoek gepubliceerd in Science rapporteert de isolatie van drie antilichamen die 90% van de Hiv-1-stammen neutraliseren in het CD4bindingsgebied van gp120, wat mogelijk een therapeutische en vaccinontwikkelingsstrategie biedt.[19] De meeste antilichamen die binden aan het CD4bindingsgebied van gp120 neutraliseren Hiv echter niet[20] en zeldzame antilichamen die dat wel doen, zoals IgG1 (b12) hebben ongebruikelijke eigenschappen zoals asymmetrie van de Fab-armen[21] of in hun positionering.[22] Tenzij een op gp120 gebaseerd vaccin gevonden kan worden dat aanzet tot de vorming van antilichamen met sterk neutraliserende antivirale eigenschappen, bestaat er bezorgdheid dat een doorbraakinfectie die leidt tot de humorale afweerproductie van hoge niveaus van niet-neutraliserende antilichamen die zich richten op de CD4-bindingsplaats van gp120 gepaard gaat met een snellere ziekteprogressie naar Aids.[23]
HIV-dementie
Het glycoproteïne gp120 induceert apoptose van zenuwcellen door het remmen van de niveaus van furine en de weefselplasminogeenactivator (IPA), enzymen die verantwoordelijk zijn voor het omzetten van proBDNF in matureBDNF.[24] Gp120 induceert mitochondriale apotose-eiwitten zoals caspasen die zorgen voor de upregulatie van de apoptose-Fas-receptor, wat leidt tot apoptose van zenuwcellen.[25] Gp120 induceert ook oxidatieve stress in de zenuwcellen.[26] Het activeert ook het STAT1 (Signal transducer and activator of transcription 1) en induceert de secretie (afscheiding) van de interleukinen IL-6 en IL-8 in zenuwcellen.[27]
Externe link
- Lintdiagram van gp120 met CD4
Bronnen, noten en/of referenties
|











