Nátrium-azid
| Nátrium-azid | |
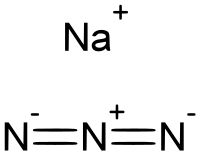 Nátrium-azid | |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 26628-22-8 |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | NaN3 |
| Moláris tömeg | 65.01 g/mol |
| Megjelenés | színtelen, szilárd |
| Sűrűség | 1.85 g/cm³, szilárd |
| Olvadáspont | 275 °C (bomlik) |
| Oldhatóság (vízben) | 42 g/100 mL (20 °C) |
| Veszélyek | |
| EU osztályozás | Mérgező vagy nagyon mérgező (T+) Veszélyes a környezetre (N)[1] |
| R mondatok | R61, R3, R20/22, R33, R50/53, R62[1] |
| S mondatok | S53, S45, S60, S61[1] |
| Rokon vegyületek | |
| Azonos kation | Nátrium-nitrát Nátrium-szulfát Nátrium-kromát |
| Azonos anion | Hidrogén-azid Ólom-azid Kálium-azid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A nátrium-azid egy kémiai vegyület, a hidrogén-azid nátriumsójának tekinthető. Képlete NaN3. Színtelen por, vízben jól oldódik. Légzsákokban, és ólom-azid előállítására használják.
Reakciói
Nátrium-azid keletkezik, ha nátrium-amid olvadékba dinitrogén-oxid gázt vezetnek.[2][3]
Előállítható nátrium-amid és nátrium-nitrát olvadékából is 175 °C-on. Melléktermékként ammónia és nátrium-hidroxid keletkezik.
Tulajdonságai
275 °C felett nátriumra és nitrogénre bomlik. Laboratóriumban így lehet nagyon tiszta nátriumot előállítani.
Savas oldatban hidrogén-azid keletkezik belőle, ami nagyon robbanásveszélyes anyag.
Az azid ion egy álhalogenid. Sok reakcióban hasonlít a halogenidekre.
Felhasználása
Felhasználás légzsákokban
A nátrium-azidot légzsákokban használják. Ütközéskor ez fújja fel a légzsákot. Az ütközésérzékelő parancsot ad, a nátrium-nitrátból, szilícium-dioxidból és nátrium-azidból álló keverék a hőmérséklet emelkedésével nitrogéngázt fejleszt, ami felfújja a légzsákot, és nátrium-szilikát marad vissza.
Felhasználás robbanóanyagok előállítására
A nátrium-azid használható más robbanóanyagok előállítására, például ólom-azid szintézisére. Itt a nátrium-azid oldathoz ólom-nitrát- vagy ólom-acetát-oldatot öntenek, és a leváló csapadékot leszűrik.
Szerves kémiában
A szerves kémiában elsősorban aminok és szerves azidok előállítására használható.
Élettani hatása
A nátrium-azid nagyon mérgező, majdnem annyira, mint a nátrium-cianid, ti. blokkolja a specifikus enzimek működését. Sejtszinten ható, ún. mitochondriális toxin, gátolja az oxidatív foszforilációt.
Források
- ↑ a b c Az ólom-azid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2011. 02. 12. (JavaScript szükséges) (angolul)
- ↑ 14. Auflage. Hirzel, Stuttgart 1995, ISBN 978-3-77-760672-9, S. 205.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 474-5.
További információk
- Pyromaster
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap














