Kötési izomer
A szerves kémiában két molekulát kötési izomernek nevezünk, ha azok egymásnak konstitúciós izomerjei, és periciklusos reakcióval egymásba átalakulhatnak.[1][2]
Benzol
A benzol C6H6 képletéhez számos kötési izomer megrajzolható: némelyiket eredetileg a benzol szerkezetének javasolták, még mielőtt a tényleges szerkezetet felismerték volna, másokat később elő is állítottak. Némelyik izomerizációval benzollá alakul, de vannak, amelyek más reakciót követnek, vagy nem periciklusos reakcióban izomerizálódnak.
- A benzol néhány ismert közési izomerje
-
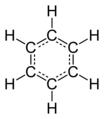 benzol
benzol -
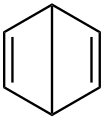 Dewar-benzol
Dewar-benzol -

-

-
 biciklopropenil
biciklopropenil
Ciklooktatetraén
Nem csak a benzolnak vannak kötési izomerjei, ilyenek a (CH)8 sorozatban is léteznek. A molekulát alkotó egységek nagyobb száma miatt a lehetséges izomerek száma is nagyobb, legalább 21:
- A ciklooktatetraén kötési izomerjei
-
 ciklooktatetraén (COT)
ciklooktatetraén (COT) -
 barrelén
barrelén -
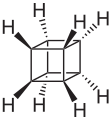 kubán
kubán -
 kuneán
kuneán -
 szemibullvalén
szemibullvalén -
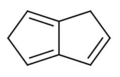 1,5-dihidropentalén
1,5-dihidropentalén -
![2a,2b,4a,4b-tetrahidrociklopropa[cd]pentalén](//upload.wikimedia.org/wikipedia/commons/thumb/5/5f/2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png/120px-2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png) 2a,2b,4a,4b-tetrahidrociklopropa[cd]pentalén
2a,2b,4a,4b-tetrahidrociklopropa[cd]pentalén -
![biciklo[4.2.0]okta-2,4,7-trién. A COT tautomerje termikus 6e vagy fotokémiai 4e folyamatokban[3][4][5]](//upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Bicyclo420octa247triene.svg/97px-Bicyclo420octa247triene.svg.png)
-
![triciklo[3,3,0,02,6]okta-3,8-dién. −60 °C-on stabil, szobahőmérsékleten szemibullvalénné izomerizálódik[6][7][8][9]](//upload.wikimedia.org/wikipedia/commons/thumb/8/84/Tricyclo33006octa38diene.svg/120px-Tricyclo33006octa38diene.svg.png)
-
![triciklo[4,2,0,02,5]okta-3,7-dién. A ciklobutadién dimerjének cisz és transz izomerje létezik, 140 °C-on 20 perces felezési idővel mindkettő COT-vé izomerizálódik (az átalakulás szimmetria tiltott, ezért az izomerek relatíve stabilak)[10]](//upload.wikimedia.org/wikipedia/commons/thumb/b/b3/Cyclobutadiene_dimer_cis_trans.svg/120px-Cyclobutadiene_dimer_cis_trans.svg.png) triciklo[4,2,0,02,5]okta-3,7-dién. A ciklobutadién dimerjének cisz és transz izomerje létezik, 140 °C-on 20 perces felezési idővel mindkettő COT-vé izomerizálódik (az átalakulás szimmetria tiltott, ezért az izomerek relatíve stabilak)[10]
triciklo[4,2,0,02,5]okta-3,7-dién. A ciklobutadién dimerjének cisz és transz izomerje létezik, 140 °C-on 20 perces felezési idővel mindkettő COT-vé izomerizálódik (az átalakulás szimmetria tiltott, ezért az izomerek relatíve stabilak)[10] -
![A tetraciklo[3,3,0,02,4,03,6] okta-7-énnek csak a 4-karbometoxi származéka ismert[11]](//upload.wikimedia.org/wikipedia/commons/thumb/4/43/Tetracyclooctaene.svg/120px-Tetracyclooctaene.svg.png) A tetraciklo[3,3,0,02,4,03,6] okta-7-énnek csak a 4-karbometoxi származéka ismert[11]
A tetraciklo[3,3,0,02,4,03,6] okta-7-énnek csak a 4-karbometoxi származéka ismert[11] -
![A tetraciklo[4,2,0,02,4,03,5] okta-7-ént benzvalénból állították elő, COT-vé izomerizálódik[12]](//upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Tetracyclooct-7-ene.svg/120px-Tetracyclooct-7-ene.svg.png) A tetraciklo[4,2,0,02,4,03,5] okta-7-ént benzvalénból állították elő, COT-vé izomerizálódik[12]
A tetraciklo[4,2,0,02,4,03,5] okta-7-ént benzvalénból állították elő, COT-vé izomerizálódik[12] -
![A pentaciklo[5.1.0.02,4.03,5.06,8]oktán (oktabiszvalén) a harmadik telített kötési izomer. (Z)-3,7-fenilszulfonil származéka 200 °C-ig stabil[13]](//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Octabisvalene.svg/120px-Octabisvalene.svg.png) A pentaciklo[5.1.0.02,4.03,5.06,8]oktán (oktabiszvalén) a harmadik telített kötési izomer. (Z)-3,7-fenilszulfonil származéka 200 °C-ig stabil[13]
A pentaciklo[5.1.0.02,4.03,5.06,8]oktán (oktabiszvalén) a harmadik telített kötési izomer. (Z)-3,7-fenilszulfonil származéka 200 °C-ig stabil[13] -
![Beszámoltak a triciklo[5.1.0.02,8]okta-3,5-dién (oktavalén) homobenzvalénből történő szintéziséről, a vegyület 50 °C-on COT-vé izomerizálódik[14][15]](//upload.wikimedia.org/wikipedia/commons/thumb/7/76/Octavalene.svg/108px-Octavalene.svg.png)
Naftalin és azulén
A színtelen naftalin és az intenzív ibolya színű azulén két, egymástól nagyon eltérő megjelenésű kötési izomer.
- A naftalin kötési izomerjei
-
 naftalin
naftalin -

Benzol-oxid és oxepin

Jegyzetek
- ↑ Valence isomer, A kémiai terminológia kompendiuma – Arany könyv (internetes kiadás). International Union of Pure and Applied Chemistry (1994)
- ↑ Rearrangements and interconversions of compounds of the formula (CH)n Lawrence T. Scott, Maitland. Jones Chem. Rev., 1972, 72 (2), pp 181–202 doi:10.1021/cr60276a004
- ↑ (1964) „The Valence Tautomerism of Cyclooctatetraene”. Angewandte Chemie International Edition in English 3 (2), 83. o. DOI:10.1002/anie.196400831.
- ↑ Bicyclo[4,2,0]octa-2,4,7-triene Emanuel Vogel, H. Kiefer, W. R. Roth Volume 3, Issue 6, pages 442–443, June 1964 doi:10.1002/anie.196404422
- ↑ (1970) „Evidence for different valence tautomers of bromocyclooctatetraene”. Journal of the American Chemical Society 92 (13), 4105. o. DOI:10.1021/ja00716a048.
- ↑ (1969) „Tricyclo[3.3.0.02,6]octa-3,7-diene”. Journal of the American Chemical Society 91 (21), 5877. o. DOI:10.1021/ja01049a034.
- ↑ (1969) „Semibullvalene from tricyclo[3.3.0.02,6]octane”. Journal of the American Chemical Society 91 (21), 5877. o. DOI:10.1021/ja01049a033.
- ↑ (1969) „C8H8 interconversions. An unusual rearrangement providing a new route to semibullvalene”. Journal of the American Chemical Society 91 (21), 5878. o. DOI:10.1021/ja01049a035.
- ↑ (1970) „(CH)8 hydrocarbons. Photochemistry of tricyclo[3.3.0.02,6]octa-3,7-diene”. Journal of the American Chemical Society 92 (8), 2579. o. DOI:10.1021/ja00711a078.
- ↑ Untersuchungen in der Cyclobutanreihe, XII. Zwei stereoisomere Dimere des Cyclobutadiens Margarete Avram, Ilie G. Dinulescu, Elise Marica, Georg Mateescu, Elvira Sliam, Costin D. Nenitzescu Chemische Berichte Volume 97, Issue 2, pages 382–389, February 1964 doi:10.1002/cber.19640970210
- ↑ Methyl tetracyclo[3.3.0.02,4O3,6]cot-7-ene-4-carboxylate Gerhard W. Klumpp, W. G. J. Rietman, J. J. Vrielink J. Am. Chem. Soc., 1970, 92 (17), pp 5266–5267 doi:10.1021/ja00720a071
- ↑ Synthesis and reactions of tetracyclo[4.2.0.02,4.03,5]octanes Leverett R. Smith, George E. Gream, Jerrold Meinwald J. Org. Chem., 1977, 42 (6), pp 927–936 doi:10.1021/jo00426a001
- ↑ (Z)-3,7 Bis(phenylsulfonyl)pentacyclo[5.1.0.02,4.03,5.06,8]octane, an Octabisvalene Derivative (1985) Angewandte Chemie International Edition in English Volume 24, Issue 5, pages 411–412 doi:10.1002/anie.198504111
- ↑ The synthesis of octavalene (tricyclo[5.1.0.02,8]octa-3,5-diene) and several substituted octavalenes Tetrahedron Volume 42, Issue 6, 1986, Pages 1585-1596 Manfred Christl, Reinhard Lang and Clemens Herzog doi:10.1016/S0040-4020(01)87575-X
- ↑ Electronic structure of octavalene. Photoelectron spectroscopic investigations Rolf Gleiter, Peter Bischof, Manfred Christl J. Org. Chem., 1986, 51 (15), pp 2895–2898 doi:10.1021/jo00365a007
- ↑ E. Vogel, H. Günther (1967). „Benzene Oxide-Oxepin Valence Tautomerism”. Angewandte Chemie International Edition in English 6 (5), 385–401. o. DOI:10.1002/anie.196703851.
Fordítás
- Ez a szócikk részben vagy egészben a Valence isomer című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap











![2a,2b,4a,4b-tetrahidrociklopropa[cd]pentalén](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png/120px-2a%2C2b%2C4a%2C4b-tetrahydrocyclopropa_cd_pentalene.png)
![biciklo[4.2.0]okta-2,4,7-trién. A COT tautomerje termikus 6e vagy fotokémiai 4e folyamatokban[3][4][5]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Bicyclo420octa247triene.svg/97px-Bicyclo420octa247triene.svg.png)
![triciklo[3,3,0,02,6]okta-3,8-dién. −60 °C-on stabil, szobahőmérsékleten szemibullvalénné izomerizálódik[6][7][8][9]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/Tricyclo33006octa38diene.svg/120px-Tricyclo33006octa38diene.svg.png)
![triciklo[4,2,0,02,5]okta-3,7-dién. A ciklobutadién dimerjének cisz és transz izomerje létezik, 140 °C-on 20 perces felezési idővel mindkettő COT-vé izomerizálódik (az átalakulás szimmetria tiltott, ezért az izomerek relatíve stabilak)[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b3/Cyclobutadiene_dimer_cis_trans.svg/120px-Cyclobutadiene_dimer_cis_trans.svg.png)
![A tetraciklo[3,3,0,02,4,03,6] okta-7-énnek csak a 4-karbometoxi származéka ismert[11]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/43/Tetracyclooctaene.svg/120px-Tetracyclooctaene.svg.png)
![A tetraciklo[4,2,0,02,4,03,5] okta-7-ént benzvalénból állították elő, COT-vé izomerizálódik[12]](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fe/Tetracyclooct-7-ene.svg/120px-Tetracyclooct-7-ene.svg.png)
![A pentaciklo[5.1.0.02,4.03,5.06,8]oktán (oktabiszvalén) a harmadik telített kötési izomer. (Z)-3,7-fenilszulfonil származéka 200 °C-ig stabil[13]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Octabisvalene.svg/120px-Octabisvalene.svg.png)
![Beszámoltak a triciklo[5.1.0.02,8]okta-3,5-dién (oktavalén) homobenzvalénből történő szintéziséről, a vegyület 50 °C-on COT-vé izomerizálódik[14][15]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/76/Octavalene.svg/108px-Octavalene.svg.png)












