Herelleviridae
| Herelleviridae | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 EM-Aufnahme eines Virions aus der | ||||||||||||||
| Systematik | ||||||||||||||
| ||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
| ||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Herelleviridae | ||||||||||||||
| Links | ||||||||||||||
|
Herelleviridae ist die Bezeichnung für eine Familie von Viren mit sog. Kopf-Schwanz-Aufbau (Klasse Caudoviricetes), deren natürlichen Wirte Mitglieder des bakteriellen Phylums Firmicutes sind.[4] Offiziell bestätigt fünf Unterfamilien, 19 Gattungen und 82 Arten (Spezies).[5] Solche Bakterien infizierenden Viren nennt man auch Bakteriophagen.[5][6] Die Herellviridae haben den Morphotyp von Myoviren; die Familie ging aus der früheren Unterfamilie Spounavirinae der inzwischen als Familie aufgelösten Myoviridae hervor.[7][5][6]
Etymologie
Der Name der Familie, Herelle, wurde anlässlich des 100. Jahrestages der Entdeckung der Bakteriophagen zu Ehren ihres Entdeckers Félix d’Hérelle (1873–1994), eines französisch-kanadischen Mikrobiologen vergeben, das Suffix ‚-viridae‘ ist das Standardsuffix für Virenfamilien.[5][6][8]
Beschreibung

Morphologie
Die Virionen (Virusteilchen) der Herelleviridae haben Kopf-Schwanz-Struktur; der Kopf ist ein ikosaedrisches Kapsid mit einem Durchmesser von 85–100 nm. Die Kapside sind nicht umhüllt und zeigen deutliche die Kapsomerr, d. h. die Kapsiduntereinheiten, diese sind in Fünf- und Sechsecken angeordnet, die sich zum ikosaedrischen Kapsid zusammenfügen. Die Kapside können bis zu 35 Proteine beherbergen. Die unkontrahierten Schwänze sind 130–185 nm lang. Der Hals hat eine Grundplatte von ca. 60 nm und einen kleinen Kragen.[5][9][6]
-
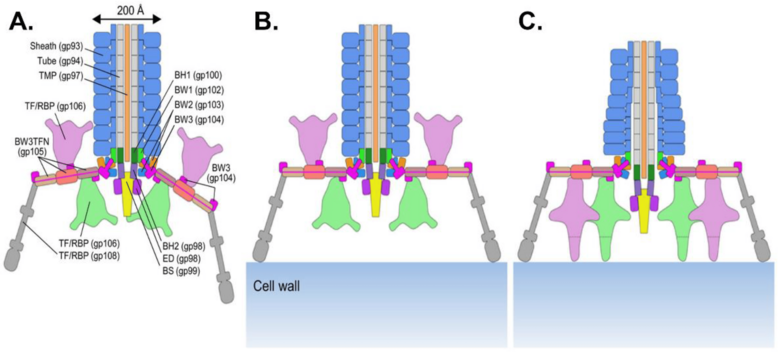 Listeria-Phage A511 (Spezies Pecentumvirus A511): Aufbau der Basisplatte und Veränderung während der Absorption an der Zellwand des Wirtsbalterium.
Listeria-Phage A511 (Spezies Pecentumvirus A511): Aufbau der Basisplatte und Veränderung während der Absorption an der Zellwand des Wirtsbalterium.
Genom
Das Genom der Herellevidae ist eine lineare doppelsträngige DNA (dsDNA) mit langen terminalen Wiederholungen (englisch repeats) von 3–16 kbp (Kilo-Basenpaaren) Länge. Die Genome sind 125–170 kbp groß und kodieren etwa 165–301 Gene. Mehrere Introns wurden auch in Herellevirus-Genomen nachgewiesen.[5][9][6]
Replikationszyklus
Die Replikation findet mit Hilfe DNA-Polymerase der Wirte statt.[5][9][6] Nach den Untersuchungen sind die Phagen dieser Familie obligat lytisch, aber einige können eine anhaltende bzw. pseudolysogene Infektion verursachen.[5][6]
Systematik
Die Herelleviridae bilden nach allgemeiner Auffassung eine monophyletische Klade, was u. a. durch genombasierten Phylogenien gut unterstützt wird. Die Familienmitglieder haben mindestens 60 % Übereinstimmung in der Nukleotidsequenz.[5][6]
Gemäß ICTV mit Stand 1. April 2024 gliedert sich die Familie Herelleviridae wie folgt in Unterfamilien und Gattungen (mit einer Auswahl an Spezies):[10][11][9][8]
Familie Herelleviridae
- Unterfamilie Bastillevirinae
- Gattung Agatevirus
- Spezies Agatevirus agate (früher Bacillus virus Agate, ehem. Typus) mit Bacillus-Phage phiAGATE
- Gattung Bastillevirus
- Spezies Bastillevirus bastille (früher Bacillus virus Bastille, ehem. Typus) mit Bacillus-Phage Bastille
- Gattung Bequatrovirus (veraltet: B4virus)
- Spezies Bequatrovirus B4 (früher Bacillus virus B4, ehem. Typus) mit Bacillus-Phage B4 und B55
- Gattung Caeruleovirus (veraltet: Bc431virus)
- Spezies Caeruleovirus Bc431 (früher Bacillus virus Bc431, ehem. Typus) mit Bacillus-Phage vB_BceM_Bc431v3
- Gattung Eldridgevirus
- Spezies Eldridgevirus eldridge mit Bacillus-Phage Eldridge
- Gattung Goettingenvirus
- Spezies Goettingenvirus goe8 mit Bacillus-Phage vB_BmeM-Goe8
- Gattung Grisebachstrassevirus
- Spezies Grisebachstrassevirus goe3 mit Bacillus-Phage vB_BsuM-Goe3
- Gattung Jeonjuvirus
- Spezies Jeonjuvirus BSP38 mit Bacillus-Phage BSP38
- Gattung Matervirus
- Spezies Matervirus mater mit Bacillus-Phage Mater
- Gattung Moonbeamvirus
- Spezies Moonbeamvirus moonbeam mit Bacillus-Phage Moonbeam
- Gattung Nitunavirus (veraltet: Nit1virus)
- Spezies Nitunavirus NIT1 (veraltet Bacillus virus NIT1, ehem. Typus) mit Bacillus-Phage phiNIT1
- Gattung Shalavirus
- Spezies Shalavirus Shbh1 mit Bacillus-Phage Shbh1
- Gattung Siophivirus
- Spezies Siophivirus SIOphi mit Bacillus-Phage SIOphi
- Gattung Tsarbombavirus
- Spezies Tsarbombavirus tsarbomba (veraltet Bacillus virus TsarBomba, ehem. Typus) mit Bacillus-Phage TsarBomba
- Gattung Wphvirus
- Spezies Wphvirus WPh (veraltet Bacillus virus WPh, ehem. Typus) mit Bacillus-Phage W.Ph.
- Unterfamilie Brockvirinae
- Gattung Kochikohdavirus
- Spezies Kochikohdavirus ECP3 (veraltet Enterococcus virus EF24C, ehem. Typus) mit Enterococcus-Phage EF24C alias φEF24C
- Gattung Schiekvirus
- Spezies Schiekvirus EFDG1 (veraltet Enterococcus virus EFDG1, ehem. Typus) mit Enterococcus-Phage EFDG1
- Unterfamilie Jasinkavirinae
- Gattung Pecentumvirus (veraltet: P100virus)
- Gattung Okubovirus (veraltet: Spo1virus, Spo1likevirus, SPO1-ähnliche Viren)[16]
- Spezies Okubovirus camphawk (veraltet Bacillus virus Camphawk) mit Bacillus-Phage CampHawk
- Spezies Okubovirus SPO1 (veraltet Bacillus virus SPO1, ehem. Typus) mit Bacillus-Phage SPO1
- Gattung Siminovitchvirus (veraltet: Cp51virus)
- Spezies Siminovitchvirus CP51 (veraltet Bacillus virus CP51, ehem. Typus) mit Bacillus-Phage CP-51
- Spezies Siminovitchvirus JL (veraltet Bacillus virus JL) mit Bacillus-Phage JL
- Spezies Siminovitchvirus shanette (veraltet Bacillus virus Shanette) mit Bacillus-Phage Shanette
- ohne Gattungszuweisung
- Spezies „Bacillus-Phage SP-10“ (wiss. „Bacillus phage SP-10“, auch SP10)[17]

- Unterfamilie Twortvirinae
- Gattung Baoshanvirus
- Spezies Baoshanvirus BS1 (veraltet Staphylococcus virus BS1) mit Staphylococcus-Phage phiSA_BS1
- Spezies Baoshanvirus BS2 (veraltet Staphylococcus virus BS2, ehem. Typus) mit Staphylococcus-Phage phiSA_BS2
- Gattung Kayvirus
- Spezies Kayvirus G1 mit Staphylococcus-Phage G1
- Spezies Kayvirus G15 mit Staphylococcus-Phage G15 alias Staphylococcus aureus phage GH15 produziert Endolysin LysGH15[18]
- Spezies Kayvirus JD7 mit Staphylococcus-Phage JD007
- Spezies Kayvirus kay (veraltet Staphylococcus virus K, ehem. Typus) mit Staphylococcus-Phage K
- Spezies Kayvirus MCE2014 mit Staphylococcus-Phage MCE-2014
- Spezies Kayvirus P108 mit Staphylococcus-Phage P108
- Spezies Kayvirus rodi mit Staphylococcus-Phage phiIPLA-RODI
- Spezies Kayvirus S253 mit Staphylococcus-Phage S25-3
- Spezies Kayvirus S254 mit Staphylococcus-Phage S25-4
- Spezies Kayvirus SA12 mit Staphylococcus-Phage phiSA12
- Spezies Kayvirus Sb1 mit Staphylococcus-Phage Sb-1
- Spezies „Staphylococcus-Phage SA3“ (wiss. „Staphylococcus phage SA3“, φSa3)[19][20][21][22]
- Gattung Sciuriunavirus
- Spezies Sciuriunavirus SscM1 (veraltet Staphylococcus virus SscM1, ehem. Typus) mit Staphylococcus-Phage vB_SscM-1
- Gattung Sepunavirus (veraltet: Sep1virus)
- Spezies Sepunavirus IPLAC1C (veraltet Staphylococcus virus IPLAC1C, ehem. Typus) mit Staphylococcus-Phage
- Spezies vB_SepM_ phiIPLA-C1C
- Spezies Sepunavirus SEP1 (veraltet Staphylococcus virus SEP1, ehem. Typus) mit Staphylococcus-Phage phiIBB-SEP1
- Gattung Silviavirus
- Spezies Silviavirus remus (veraltet Staphylococcus virus Remus, ehem. Typus) mit Staphylococcus-Phage vB_SauM_Remus und vB_SauM_Romulus
- Spezies Silviavirus stau2 mit Staphylococcus-Phage Stau2[23]
- Gattung Twortvirus (veraltet: Twortlikevirus, früher zur Familie Myoviridae, da vom Morphotyp Myoviren)[24]
- Spezies Twortvirus twort (veraltet Staphylococcus virus Twort, ehem. Typus) mit Staphylococcus-Phage Twort[25]
- ohne zugewiesene Unterfamilie
- Gattung Elpedvirus
- Spezies Elpedvirus LpeD mit Lactobacillus-Phage LpeD
- Gattung Harbinvirus
- Spezies Harbinvirus Lpa804 (veraltet Lactobacillus virus Lpa804, ehem. Typus) mit Lactobacillus-Phage Lpa804
- Gattung Hopescreekvirus
- Spezies Hopescreekvirus LfeInf mit Lactobacillus-Phage LfeInf
- Gatting Klumppvirus
- Spezies Klumppvirus A9 (veraltet Brochothrix virus A9, ehem. Typus) mit Brochothrix-Phage A9[26][27], infiziert Bakterien der Gattung Brochothrix, Familie Listeriaceae. Nicht zu verwechseln mit dem Riesenphagen Huge Phage A9.[28]
- Gattung Mooreparkvirus
- Spezies Mooreparkvirus Lb3381 (veraltet Lactobacillus virus Lb338-1, ehem. Typus) mit Lactobacillus-Phage Lb338-1
- Gattung Salchichonvirus
- Spezies Salchichonvirus LP65 (veraltet Lactobacillus virus LP65, ehem. Typus) mit Lactobacillus-Phage LP65
- Spezies Lactobacillus-Virus LP65
- Gattung Tybeckvirus
- Spezies Tybeckvirus SAC12B mit Lactobacillus-Phage SAC12B
- Spezies Tybeckvirus tv521B mit Lactobacillus-Phage 521B
- Gattung Watanabevirus
- Spezies Watanabevirus wv3521 mit Lactobacillus-Phage 3-521
Weitere Vorschläge findet man bei NCBI.[29]
Einzelnachweise
- ↑ ICTV: ICTV Master Species List 2021.v2, New MSL including some corrections.
- ↑ ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)
- ↑ ICTV: ICTV Master Species List 2020.v1, New MSL including all taxa updates since the 2019 release, March 2021 (MSL #36)
- ↑ Jakub Barylski, Andrew M. Kropinski, Nabil-Fareed Alikhan, Evelien M. Adriaenssens, ICTV Report Consortium: ICTV Virus Taxonomy Profile: Herelleviridae. In: The Journal of General Virology. 101. Jahrgang, Nr. 4, April 2020, S. 362–363, doi:10.1099/jgv.0.001392, PMID 32022658 (englisch).
- ↑ a b c d e f g h i Jakub Barylski, Andrew M. Kropinski, Nabil-Fareed Alikhan, Evelien M. Adriaenssens: ICTV Report Herelleviridae. 2020; abgerufen im 1. Januar 1 (englisch). Via ictvonline (Memento vom 20. September 2020 im Internet Archive).
- ↑ a b c d e f g h Jakub Barylski, François Enault, Bas E. Dutilh, Margo B. P. Schuller, Robert A. Edwards, Annika Gillis, Jochen Klumpp, Petar Knezevic, Mart Krupovic, Jens H. Kuhn, Rob Lavigne, Hanna Maarit Oksanen, Matthew B. Sullivan, Ho Bin Jang, Peter Simmonds, Pakorn Aiewsakun, Johannes Wittmann, Igor Tolstoy, J. Rodney Brister, Andrew M. Kropinski (2020). Taxonomy proposal: To create one (1) new family, Herelleviridae, in the order Caudovirales. University of Helsinki.
- ↑ Dann Turner, Andrew M. Kropinski, Evelien M. Adriaenssens: A Roadmap for Genome-Based Phage Taxonomy, in: MDPI Viruses Band 13, Nr. 3, Section Bacterial Viruses, 18. März 2021, 506, doi:10.3390/v13030506
- ↑ a b Jakub Barylski, François Enault, Bas E. Dutilh, Margo B. P. Schuller, Robert A. Edwards, Annika Gillis, Jochen Klumpp, Petar Knezevic, Mart Krupovic, Jens H. Kuhn et al.: Analysis of Spounaviruses as a Case Study for the Overdue Reclassification of Tailed Phages. In: Systematic Biology, Band 69, Nr. 1, Januar 2020, S. 110–123; doi:10.1093/sysbio/syz036, Epub 25. Mai 2019 (englisch)
- ↑ ICTV: Taxonomy Browser.
- ↑ ICTV: Virus Metadata Resource (VMR).
- ↑ ICTV: ICTV Taxonomy history: Listeria virus A511
- ↑ NCBI: Listeria virus A511 (species)
- ↑ Matthew Dunne, Mario Hupfeld, Jochen Klumpp, Martin J. Loessner: Molecular Basis of Bacterial Host Interactions by Gram-Positive Targeting Bacteriophages, in: MDPI Viruses, Band 10, Nr. 8, Special Issue Phage-Host Interactions, 397, 28. Juli 2018, doi:10.3390/v10080397.
- ↑ Jakub Barylski, François Enault, Bas E. Dutilh, Margo B. P. Schuller, Robert A. Edwards, Annika Gillis, Jochen Klumpp, Petar Knezevic, Mart Krupovic, Jens H. Kuhn et al.: Analysis of Spounaviruses as a Case Study for the Overdue Reclassification of Tailed Phages, in: Systematic Biology, Band 69, Nr. 1, Januar 2020, S. 110–123, Epub 25. Mai 2019, doi:10.1093/sysbio/syz036
- ↑ SIB: Okubovirus (syn. Spo1virus). Auf: ViralZone.
- ↑ NCBI: Bacillus phage SP-10 (species)
- ↑ Angela França, Vânia Gaio, Nathalie Lopes, Luís D. R. Melo: Virulence Factors in Coagulase-Negative Staphylococci. In: MDPI Pathogens, Band 10, Nr. 2,4. Februar 2021, S. 170; doi:10.3390/pathogens10020170, PMID 33557202, PMC 7913919 (freier Volltext) (englisch).
- ↑ NCBI: Staphylococcus phage SA3 (species)
- ↑ Marta Matuszewska, Gemma G. R. Murray, Xiaoliang Ba, Rhiannon Wood, Mark A. Holmes, Lucy A. Weinert: Stable antibiotic resistance and rapid human adaptation in livestock-associated MRSA. In: eLife, 28. Juni 2022; doi:10.7554/eLife.74819 (englisch). Dazu:
- Highly Antibiotic-Resistant Superbug Strain Discovered To Be Able To Infect Humans. Auf: SciTechDaily vom 3. August 2022. Quelle: University of Cambridge.
- ↑ Romain Guérillot, Xenia Kostoulias, Liam Donovan, Lucy Li, Glen P. Carter, Abderrahman Hachani, Koen Vandelannoote, Stefano Giulieri, Ian R. Monk, Mayu Kunimoto, Lora Starrs, Gaétan Burgio, Torsten Seemann, Anton Y. Peleg, Timothy P. Stinear, and Benjamin P. Howden: Unstable chromosome rearrangements in Staphylococcus aureus cause phenotype switching associated with persistent infections. In: PNAS, Band 116, Nr. 40, 16. September 2019, S. 20135-2014; doi:10.1073/pnas.1904861116, ResearchGate:335865826 (englisch). Siehe insbes. Fig. 1.
- ↑ Vijay Aswani, Fares Najar, Madhulatha Pantrangi, Bob Mau, William R. Schwan & Sanjay K. Shukla: Virulence factor landscape of a Staphylococcus aureus sequence type 45 strain, MCRF184. In: BMC Genomics, Band 20, Nr. 123, 8. Februar 2019, Projekt: MCRF184; doi:10.1186/s12864-018-5394-2; ResearchGate:330978998 (englisch).
- ↑ Sue-Er Hsieh, Hsueh-Hsia Lo, Shui-Tu Chen, Mong-Chuan Lee, Yi-Hsiung Tseng: Wide Host Range and Strong Lytic Activity of Staphylococcus aureus Lytic Phage Stau2. In: ASM Journals: Applied and Environmental Microbiology, Band 77, Nr. 3, 27. Januar 2011; doi:10.1128/AEM.01848, PMID 21148689, PMC 3028737 (freier Volltext) (englisch).
- ↑ SIB: Twortvirus. Auf: ViralZone.
- ↑ Roman Pantůček, J. Doskar, V. Růzicková, P. Kaspárek et al.: Identification of bacteriophage types and their carriage in Staphylococcus aureus. In: Archives of Virology, Band 149, Nr. 9, S. 1689–1703, Oktober 2004; doi:10.1007/s00705-004-0335-6, PMID 15593413 (englisch)
- ↑ NCBI: Brochothrix virus A9 (species) – keine Unterfamilie zugeordnet
- ↑ Samuel Kilcher, Martin J. Loessner, Jochen Klumpp: Brochothrix thermosphacta bacteriophages feature heterogeneous and highly mosaic genomes and utilize unique prophage insertion sites. In: Journal of Bacteriology, Band 192, Nr. 20, Oktober 2010, S. 5441–5453; doi:10.1128/JB.00709-10, PMID 20709901, PMC 2950505 (freier Volltext), Epub 13. August 2010 (englisch) – veraltet: Myoviridae: Spounavirinae
- ↑ Basem Al-Shayeb, Rohan Sachdeva, Lin-Xing Chen, Cindy J. Castelle, Alexander L. Jaffe, Jennifer A. Doudna, Jillian F. Banfield et al.: Clades of huge phage from across Earth’s ecosystems. In: Nature, Band 578, 12. Februar 2020, S. 425–431; doi:10.1038/s41586-020-2007-4 (englisch). Dazu:
- bioRxiv, PrePrint vom 11. März 2019, doi:10.1101/572362
- Huge bacteria-eating viruses close gap between life and non-life – Large bacteriophages carry bacterial genes, including CRISPR and ribosomal proteins; auf: EurekAlert! vom 12. Februar 2020
- ↑ NCBI: Herelleviridae (family)











