Enllaç C-I
Els compostos d'organoiode (o compostos orgànics de l'iode) són compostos químics que contenen un enllaç químic entre carboni (C) i iode (I) (enllaç C-I). La química de l'organoiode és la química dels compostos organometàl·lics que contenen un enllaç químic carboni-rodi i descriu les propietats físiques, la síntesi, les reaccions i l'ús d'aquests compostos.
Es troben àmpliament en química orgànica, però són relativament rars a la natura. Les hormones de la tiroxina són compostos organoiodats necessaris per a la salut i el motiu de la iodització de la sal obligada per molts governs.
Estructura, enllaç, propietats generals
Gairebé tots els compostos d'organoiode presenten iodur connectat a un centre de carboni. Normalment es classifiquen com a derivats de I−. Alguns compostos organoiodats presenten iode en estats d'oxidació més alts.[1]
L'enllaç C-I és el més feble dels enllaços carboni-halogen. Aquestes forces d'enllaç es correlacionen amb l'electronegativitat de l'halogen, decreixent en l'ordre F > Cl > Br > I. Aquest ordre periòdic també segueix el radi atòmic dels halògens i la longitud de l'enllaç carboni-halogen. Per exemple, a les molècules representades per CH₃X, on X és un halogenur, els enllaços carboni-X tenen forces, o energies de dissociació d'enllaços, de 115, 83,7, 72,1 i 57,6 kcal/mol per X = fluorur, clorur, bromur, i iodur, respectivament.[2] Dels halogenurs, el iodur sol ser el millor grup sortint. A causa de la debilitat de l'enllaç C–I, les mostres de compostos organoiode solen ser grogues a causa d'una impuresa de I₂.
Un aspecte destacable dels compostos d'organoiode és la seva alta densitat, que sorgeix de l'elevat pes atòmic del iode. Per exemple, un mil·lilitre de iodur de metilè pesa 3,325 g.
Aplicacions industrials
Pocs compostos organoiodats són importants industrialment, almenys pel que fa a la producció a gran escala. Els intermediaris que contenen iodur són comuns en la síntesi orgànica, a causa de la fàcil formació i ruptura de l'enllaç C-I. Els compostos organoiodificats industrialment significatius, sovint utilitzats com a desinfectants o pesticides, són el iodoform (CHI₃), el iodur de metilè (CH₂I₂) i el iodur de metil (CH₃I).[3] Tot i que el iodur de metil no és un producte important a nivell industrial, és un intermedi important, ja que és un intermedi generat de manera transitòria en la producció industrial d'àcid acètic i anhídrid acètic. S'ha considerat el potencial del iodur de metil per substituir la dependència omnipresent del bromur de metil com a fumigant del sòl, però hi ha informació limitada disponible sobre el comportament ambiental del primer.[4] El ioxinil(3,5-diiodo-4-hidroxibenzonitril), que inhibeix la fotosíntesi al fotosistema II, és un dels pocs herbicides organoiodificats. Un membre de la classe d'herbicida hidroxibenzonitril, l'ioxinil, és un anàleg iodat de l'herbicida bromat bromoxinil (3,5-dibromo-4-hidroxibenzonitril).
Els compostos orgànics iodats i bromats són preocupants com a contaminants ambientals a causa de la informació molt limitada disponible sobre el comportament del destí ambiental. No obstant això, informes recents han mostrat una promesa en la desintoxicació biològica d'aquestes classes de contaminants. Per exemple, la iodotirosina deiodinasa és un enzim de mamífer amb la funció inusual de deshalogenació reductora aeròbica de substrats orgànics substituïts amb iode o brom.[5] S'ha demostrat que els herbicides bromoxinil i ioxinil pateixen una varietat de transformacions ambientals, inclosa la dehalogenació reductora per bacteris anaeròbics.[6]
-
 Iodur de metil, precursor de l'àcid acètic sintètic
Iodur de metil, precursor de l'àcid acètic sintètic -
 Eritrosina, un colorant alimentari comú
Eritrosina, un colorant alimentari comú -
 Ioversol, un compost d'organoiode utilitzat com a agent de contrast de raigs X
Ioversol, un compost d'organoiode utilitzat com a agent de contrast de raigs X
Els compostos poliiodoorgànics de vegades s'utilitzen com a agents de contrast de raigs X, en fluoroscòpia, un tipus d'imatge mèdica. Aquesta aplicació aprofita la capacitat d'absorció de raigs X del nucli de iode pesat. Hi ha una varietat d'agents disponibles comercialment, molts són derivats de l'1,3,5-triiodobenzè i contenen al voltant del 50% en pes de iode. Per a la majoria de les aplicacions, l'agent ha de ser altament soluble en aigua i, per descomptat, no tòxic i fàcilment excretat. Un reactiu representatiu és Ioversol,[7] que té substituents diols solubilitzants en aigua. Les aplicacions típiques inclouen la urografia i l'angiografia.
-
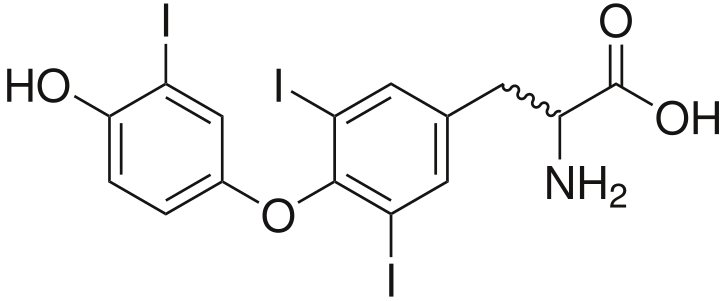 Triiodotironina (T₃), una hormona tiroidal
Triiodotironina (T₃), una hormona tiroidal -
 Tiroxina (T₄), una altra hormona tiroidal
Tiroxina (T₄), una altra hormona tiroidal
Els lubrificants organoiodificats es poden utilitzar amb titani, acers inoxidables i altres metalls que tendeixen a agafar-se amb lubrifricants convencionals: els lubrificants organoiodificats es poden utilitzar en turbines i naus espacials, i com a oli de tall en el mecanitzat.[8]
Paper biològic
Pel que fa a la salut humana, els compostos d'organoiode més importants són les dues hormones tiroidals tiroxina (T₄) i triiodotironina (T₃).[9] Els productes naturals marins són fonts riques de compostos d'organoiode, com les placohipaforines descobertes recentment de l'esponja Plakortis simplex.
S'estima que la suma de iodometà produït pel medi marí, l'activitat microbiana als arrossars i la crema de material biològic és de 214 quilotones anuals.[10] El iodometà volàtil es trenca per reaccions d'oxidació a l'atmosfera i s'estableix un cicle global del iode. S'han identificat més de 3000 compostos d'organoiode.[11]
Mètodes de preparació de l'enllaç C-I
A partir de I₂
Els compostos d'organoiode es preparen per nombroses vies, depenent del grau i la regioquímica de la iodació buscada així com de la naturalesa dels precursors. La iodació directa amb I₂ s'utilitza amb substrats insaturats:
- RHC=CH₂ + I₂ → RHIC-CIH₂
Aquesta reacció s'utilitza per determinar l'índex de iode, un indicador de la insaturació de greixos i mostres relacionades..
A partir de fonts de I−
L'anió iodur és un bon nucleòfil i desplaçarà clorur, bromur i altres grups sortints, com en la reacció de Finkelstein.
Els alcohols es poden convertir en els iodurs corresponents mitjançant triiodur de fòsfor. Un exemple és la conversió de metanol a iodometà:[12]
- PI₃ + 3 CH
3OH → 3 CH
3I + "H
3PO
3"
Per a substrats d'alcohol voluminosos, s'ha utilitzat el metiodur de trifenilfosfit.[13]
- [CH₃(C₆H₅O)₃P]+I− + ROH → RI + CH₃(C₆H₅O)₂PO + C₆H₅OH
Els iodurs aromàtics es poden preparar mitjançant una sal de diazoni mitjançant tractament amb iodur de potassi:[14]
A partir de fonts de I+
El benzè es pot iodar amb una combinació de iodur i àcid nítric.[15]
El monoclorur de iode és un reactiu que de vegades s'utilitza per lliurar l'equivalent de «I+».
Referències
- ↑ Fallis i Tessier, 2003.
- ↑ Blanksby i Ellison, 2003, p. 255-263.
- ↑ Lyday, 2005.
- ↑ Allard i Neilson, 2003, p. 1-74.
- ↑ McTammey i Rokita, 2010, p. 14212-14213.
- ↑ Cupples, Sanford i Sims, 2005, p. 3741-3746.
- ↑ Speck i Hübner-Steiner, 2005.
- ↑ «Key Lubrication Ingredient: Iodine Moves to Space Age» (en anglès). Schenectady Gazette, 17-11-1965.
- ↑ Gribble, 1996, p. 1-423.
- ↑ Bell et al., 2002, p. 4340.
- ↑ Dembitsky i Tolstikov, 2003.
- ↑ King i Hartman, 1933, p. 60.
- ↑ Rydon, 1971, p. 44.
- ↑ Lucas i Kennedy, 1939, p. 55.
- ↑ Dains i Brewster, 1992, p. 46.
Bibliografia
- Allard, A. S.; Neilson, A. H.. «Degradation and transformation of organic bromine and iodine compounds: comparison with their chlorinated analogues». A: The Handbook of Environmental Chemistry (en anglès). 3, 2003.
- Bell, N; Hsu, L.; Jacob, D. J.; Schultz, M. G.; Blake, D. R.; Butler, J. H.; King, D. B.; Lobert, J. M.; Maier-Reimer, E. «Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models» (en anglès). Journal of Geophysical Research, 107(D17), 2002. Bibcode: 2002JGRD..107.4340B. DOI: 10.1029/2001JD001151.
- Blanksby, S. J.; Ellison, G. B. «Bond dissociation energies of organic molecules» (en anglès). Acc. Chem. Res., 36(4), abril 2003. DOI: 10.1021/ar020230d. PMID: 12693923.
- Cupples, A. M.; Sanford, R. A.; Sims, G. K. «Dehalogenation of Bromoxynil (3,5-Dibromo-4-Hydroxybenzonitrile) and Ioxynil (3,5-Diiodino-4-Hydroxybenzonitrile) by Desulfitobacterium chlororespirans» (en anglès). Appl. Env. Micro., 71(7), 2005.
- Dains, F. B.; Brewster, R. Q. «Iodobenzene» (en anglès). Organic Syntheses, 9, 1929. DOI: 10.15227/orgsyn.009.0046.
- Dembitsky, V. M.; Tolstikov, G. A. «Naturally occurring organohalogen compounds - A comprehensive survey» (en anglès). Nauka Press [Novosibirsk], 2003.
- Fallis, Alex G.; Tessier, Pierre E. «2-Iodoxybenzoic acid (IBX)1». A: Encyclopedia of Reagents for Organic Synthesis (en anglès). John Wiley, 2003. DOI 10.1002/047084289X.rn00221.
- Gribble, G. W. «Naturally occurring organohalogen compounds - A comprehensive survey» (en anglès). Progress in the Chemistry of Organic Natural Products, 68(10), 1996. DOI: 10.1021/np50088a001. PMID: 8795309.
- King, C. S.; Hartman, W. W «Methyl Iodide» (en anglès). Organic Syntheses, 13, 1933. DOI: 10.15227/orgsyn.013.0060.
- Lucas, H. J.; Kennedy, E. R. «Iodobenzene» (en anglès). Organic Syntheses, 19, 1939. DOI: 10.15227/orgsyn.019.0055.
- Lyday, Phyllis A. «Iodine and Iodine Compounds». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim: Wiley-VCH, 2005. DOI 10.1002/14356007.a14_381.
- Rydon, H. N. «Alkyl Iodides: Neopentyl Iodide and Iodocyclohexane» (en anglès). Organic Syntheses, 51, 1971. DOI: 10.15227/orgsyn.051.0044.
- Speck, Ulrich; Hübner-Steiner, Ute. «Radiopaque Media». A: Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim: Wiley-VCH, 2005. DOI 10.1002/14356007.a22_593.







